रासायनिक संकेत (Chemical Symbol): किसी तत्व के लम्बे नाम को संक्षिप्त रूप में व्यक्त करने के लिए प्रयुक्त अक्षर या अक्षर समूह को रासायनिक संकेत कहते हैं।
आधुनिक रासायनशास्त्र में तत्वों के संकेत प्रसिद्ध जर्मन वैज्ञानिक बर्जीलियस द्वारा विकसित प्रणाली के अनुसार दिए जाते हैं। बर्जीलियस ने इस प्रणाली का विकास 1811 ई० में किया था। इस प्रणाली के अनुसार-
(i) किसी तत्व के अंग्रेजी, फ्रेंच या जर्मन नाम का प्रथम अक्षर उस तत्व का संकेत होता है। उदाहरण-
| तत्व का नाम | संकेत | तत्व का नाम | संकेत |
| हाइड्रोजन (Hydrogen) | H | कार्बन (Carbon) | C |
| नाइट्रोजन (Nitrogen) | N | ऑक्सीजन (Oxygen) | O |
| फ्लोरीन (Fluorine) | F | फॉस्फोरस (Phosphorus) | P |
(ii) यदि दो या दो से अधिक तत्वों के नाम एक ही अक्षर से शुरू होते हों, तो ऐसी स्थिति में प्रत्येक तत्व के नाम का प्रथम अक्षर तथा उसके नाम का कोई अन्य प्रधान अक्षर उस तत्व के संकेत के लिए प्रयुक्त किये जाते हैं। संकेत का प्रथम अक्षर हमेशा बड़ा (Capital) तथा दूसरा अक्षर हमेशा छोटा (small) लिखा जाता है। उदाहरण-
| तत्व का नाम | संकेत | तत्व का नाम | संकेत |
| बेरियम (Barium) | Ba | मैग्नीशियम (Magnesium) | Mg |
| कैल्सियम (Calcium) | Ca | क्लोरीन (Chlorine) | Cl |
| ब्रोमीन (Bromine) | Br | बिस्मथ (Bismuth) | Bi |
| मैंगनीज (Manganese) | Mn | मॉलिब्डेनम (Molybdenum) | Mo |
(iii) कुछ तत्वों के संकेत उनके लैटिन नामों पर आधारित होते हैं। उदाहरण-
| तत्व का सामान्य नाम | तत्व का लैटिन नाम | संकेत |
| सोडियम (Sodium) | नैट्रियम (Natrium) | Na |
| तांबा (Copper) | क्यूप्रम (Cuprum) | Cu |
| पोटैशियम (Potassium) | कैलियम (Kalium) | K |
| चाँदी (Silver) | अर्जेण्टम (Argentum) | Ag |
| लोहा (Iron) | फेरम (Ferrum) | Fe |
| सोना (Gold) | औरम (Aurum) | Au |
रासायनिक सूत्र (Chemical Formula): किसी तत्व अथवा यौगिक के अणु को संक्षिप्त रूप में व्यक्त करने के लिए संकेतों के समूह को रासायनिक सूत्र कहते हैं। रासायनिक सूत्र तीन प्रकार के होते हैं-
- अणु सूत्र (Molecular Formula): किसी तत्व या यौगिक के अणु में उपस्थित तत्वों के परमाणुओं की वास्तविक संख्या व्यक्त करने वाले सूत्र को तत्व या यौगिक का अणुसूत्र कहते हैं, उदाहरण के लिए, हाइड्रोजन के एक अणु में हाइड्रोजन के दो परमाणु होते हैं, अतः हाइड्रोजन का अणुसूत्र H2 होता है। इसी प्रकार जल के एक अणु में हाइड्रोजन के दो तथा ऑक्सीजन का एक परमाणु होते हैं। अतः जल का अणु सूत्र H2O होता है।
- मूलानुपाती सूत्र (Empirical Formula): किसी यौगिक में उपस्थित तत्वों के परमाणुओं की संख्याओं के सरल अनुपात को व्यक्त करने वाले सूत्र को उस यौगिक का मूलानुपाती सूत्र कहते हैं। उदाहरण के लिए- एथेन (C2H2) के एक अणु में कार्बन और हाइड्रोजन के क्रमशः 2 एवं 6 परमाणु हैं। इसमें कार्बन (C) और हाइड्रोजन (H) के परमाणुओं की संख्या का सरल अनुपात 1:3 है, अतः एथेन का मूलानुपाती सूत्र CH3 होता है। इसी प्रकार एसीटिलीन (C2H2) तथा बेंजीन (C6H6) का मूलानुपाती सूत्र CH होता है, क्योंकि इन दोनों यौगिकों में कार्बन और हाइड्रोजन के परमाणुओं की संख्या का सरल अनुपात 1 : 1 है।
- संरचना सूत्र (Structural Formula): किसी यौगिक के अणु में तत्वों के परमाणुओं की सजावट प्रदर्शित करने वाले सूत्र को उस यौगिक का संरचना सूत्र कहते हैं।
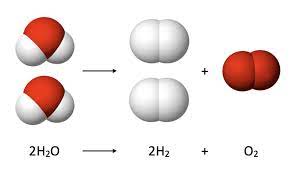
रासायनिक समीकरण (Chemical Equation): रासायनिक संकेतों एवं अणुसूत्रों की सहायता से किसी वास्तविक रासायनिक अभिक्रिया के संक्षिप्त निरूपण को रासायनिक समीकरण कहते हैं। जैसे- कार्बन ऑक्सीजन में जलकर कार्बन डाइऑक्साइड बनाता है। इस अभिक्रिया को शब्दों में इस प्रकार व्यक्त किया जा सकता है-
कार्बन + ऑक्सीजन → कार्बन डाइऑक्साइड
इस रासायनिक अभिक्रिया को संकेतों और सूत्रों का प्रयोग करके निम्नलिखित प्रकार से व्यक्त किया जाता है-
C + O2 → CO2
ऊष्मा रासायनिक समीकरण (Thermochemical Equations): ऐसे रासायनिक समीकरण जिनमें रासायनिक अभिक्रिया के फलस्वरूप होने वाले ऊष्मा परिवर्तन व्यक्त किये रहते हैं, ऊष्मा रासायनिक समीकरण कहलाते हैं। रासायनिक अभिक्रिया में मुक्त ऊष्मा को ‘+’ चिह्न द्वारा एवं अवशोषित ऊष्मा को ‘-’ चिह्न के साथ समीकरण के अंत में लिख दिया जाता है। उदाहरण के लिए, नाइट्रोजन एवं ऑक्सीजन की अभिक्रिया द्वारा नाइट्रिक ऑक्साइड के बनने में ऊष्मा का अवशोषण होता है, अतः अवशोषित ऊष्माओं के मान को ऋण चिह्नों (-) के साथ समीकरण के अंत में लिखा जाता है। जिस अभिक्रिया में ऊष्मा का अवशोषण होता है, उसे ऊष्माशोषी अभिक्रिया (Endothermic Reaction) कहते हैं।
N (नाइट्रोजन) + O (ऑक्सीजन) ⇌ 2NO (नाइट्रिक ऑक्साइड) -43.6 किलो कैलोरी
नाइट्रोजन एवं हाइड्रोजन की अभिक्रिया द्वारा अमोनिया के बनने में ऊष्मा मुक्त होती है। अतः मुक्त ऊष्माओं के मान को धन चिह्न (+) के साथ समीकरण के अंत में लिख दिया जाता है। जिस अभिक्रिया में ऊष्मा मुक्त होती है, उसे ऊष्माक्षेपी अभिक्रिया (Exothermic Reaction) कहते हैं।
N2 (नाइड्रोजन) + 3H2 (हाइड्रोजन) ⇌ 2NH3 (अमोनिया) + 22.5 किलो कैलोरी
रासायनिक समीकरण में → चिह्न अनुत्क्रमणीय अभिक्रिया के लिए तथा ⇌ चिह्न उत्क्रमणीय अभिक्रिया के लिए प्रयुक्त किए जाते हैं।
- रासायनिक अभिक्रियाओं में ऊर्जा परिवर्तन
रासायनिक अभिक्रियाएँ सदा ही ऊर्जा परिवर्तन के साथ होती हैं। रासायनिक अभिक्रियाओं में भाग लने वाले अभिकारक अधिक स्थायी निम्न ऊर्जा-स्तर प्राप्त कर लेने की प्रवृत्ति रखते हैं। इसी प्रवृत्ति के कारण रासायनिक अभिक्रियाएँ होती हैं। रासायनिक अभिक्रिया तब होती है जब अभिकारकों की ऊर्जा प्रतिफल की ऊर्जा से अधिक हो।
सक्रिय या उत्तेजित अवस्था (Activated or Excited State): किसी भी रासायनिक अभिक्रिया के पूर्व अभिकारक कुछ अतिरिक्त ऊर्जा का अवशोषण करके एक उच्चतर ऊर्जा अवस्था में परिवर्तित हो जाते हैं। यह अवस्था सक्रिय या उत्तेजित अवस्था (activated or excited state) कहलाती है।
सक्रियण ऊर्जा (Activation Energy): अभिकारकों के सक्रिय या उत्तेजित अवस्था में परिवर्तित होने के लिए अवशोषित अतिरिक्त ऊर्जा को सक्रियण ऊजf (Activation Energy) कहते हैं। दूसरे शब्दों में, अभिकारकों को सामान्य अवस्था से उत्तेजित अवस्था में लाने के लिए जितनी अतिरिक्त ऊर्जा की आवश्यकता होती है, उसे अभिक्रिया की सक्रियण ऊजा कहते हैं।
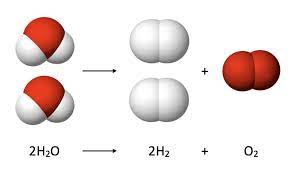
ऊर्जा परिवर्तन के आधार पर रासायनिक अभिक्रियाओं को दो भागों में बांटा जा सकता है
- ऊष्माक्षेपी अभिक्रियाएँ (Exothermic Reactions): वे रासायनिक अभिक्रियाएँ जिनसे ऊष्मा का उत्सर्जन होता है, ऊष्माक्षेपी अभिक्रियाएँ कहलाती हैं। उदाहरण- (i) नाइट्रोजन और हाइड्रोजन के परस्पर संयोग से अमोनिया बनता है तथा इस अभिक्रिया में काफी ऊर्जा मुक्त होती है। अतः अमोनिया का बनना एक ऊष्माक्षेपी अभिक्रिया है।
N2 + 3H2 → 2NH3 + ऊष्मा
(ii) कार्बन को हवा में जलाने पर कार्बन डाइऑक्साइड बनता है, इस अभिक्रिया में भी ऊष्मा मुक्त होती है। अतः यह एक ऊष्माक्षेपी अभिक्रिया है।
C + O2 → CO2 + ऊष्मा
- ऊष्माशोषी अभिक्रियाएँ (Endothermic Reactions): वे रासायनिक अभिक्रियाएं जिनमें ऊष्मा का अवशोषण होता है, ऊष्माशोषी अभिक्रियाएँ कहलाती हैं। उदाहरण-(i) नाइट्रोजन एवं ऑक्सीजन के मिश्रण को उच्च ताप (3000°C) पर गर्म करने से नाइट्रिक ऑक्साइड बनता है। इस अभिक्रिया में काफी मात्रा में ऊर्जा का अवशोषण होता है।
N2 + O2 + ऊष्मा → 2NO
(ii) कार्बन और गंधक (सल्फर) परस्पर संयोग कर कार्बन डाइसल्फाइड बनाते हैं। इस अभिक्रिया में भी ऊष्मा का अवशोषण होता है। अतः यह एक ऊष्माशोषी अभिक्रिया है।
C + 2S + ऊष्मा → CS2
बंधन ऊर्जा (Bond Energy): किसी पदार्थ के एक मोल में उपस्थित सभी बंधनों को तोड़कर अणुओं को परमाणुओं में परिवर्तित करने के लिए आवश्यक ऊर्जा को उस पदार्थ का बंधन ऊर्जा (Bond Energy) कहते हैं। दूसरे शब्दों में, मुक्त परमाणुओं के बीच परस्पर संयोग कराकर किसी पदार्थ के एक मोल में सभी बंधनों का निर्माण कराने पर जितनी ऊर्जा उत्सर्जित होती है, उसे उस पदार्थ की बंधन ऊर्जा कहते हैं, बंधन ऊर्जा को किलो जूल प्रति मोल में व्यक्त किया जाता है।
नोट:
- बंधनों का टूटना ऊष्माशोषी अभिक्रिया है, जबकि बधनों का निर्माण ऊष्माक्षेपी अभिक्रिया।
- किसी पदार्थ में उपस्थित कुल बंधनों की ऊजf को उस पदार्थ की उर्जा कहते हैं।
- यदि नए बंधनों के निर्माण के फलस्वरूप मुक्त उर्जा पुराने बंधनों को तोड़ने के लिए आवश्यक उर्जा से अधिक है, तब वह रासायनिक अभिक्रिया ऊष्माक्षेपी होगी।
- यदि नए बंधनों के निर्माण के फलस्वरूप मुक्त उर्जा पुराने बंधनों को तोड़ने के लिए आवश्यक उर्जा से कम होती है, तब वह रासायनिक अभिक्रिया ऊष्माशोषी होगी।
प्रकाश रसायन (Photo Chemistry): प्रकाश-रसायन रसायन विज्ञान की वह शाखा है, जिसके अंतर्गत उन रासायनिक अभिक्रियाओं का अध्ययन किया जाता है जो प्रकाश ऊर्जा के अवशोषण के फलस्वरूप घटित होती हैं।
प्रकाश रासायनिक अभिक्रिया (Photo chemical Reactions): वे रासायनिक अभिक्रियाएँ जो प्रकाश ऊर्जा के अवशोषण के फलस्वरूप घटित होती हैं, प्रकाश रासायनिक अभिक्रियाएँ कहलाती है। जैसे-
(a) हाइड्रोजन और क्लोरीन का संयोग
H2 (g) + Cl2(g) -(सूर्य का प्रकाश) → 2HCl(g)
(b) क्लोरीन का विघटन
Cl2 (क्लोरीन अणु) प्रकाश ऊर्जा → 2Cl (क्लोरीन परमाणु)
(c) प्रकाश संश्लेषण क्रिया सूर्य का प्रकाश
6CO2, + 12 12H2O → C6H12O6 + 6H2O+ 6O2
प्रकाश संश्लेषण प्रकाश रासायनिक अभिक्रिया का एक अच्छा उदाहरण है, जो सूर्य के प्रकाश की उपस्थिति में हरे पेड़-पौधों में होती है। इसमें प्रकाश ऊर्जा रासायनिक ऊर्जा में बदल जाती है।
धातु संक्षारण (Metallic Corrosion): धातु का संक्षारण एक ऑक्सीकरण-अवकरण अभिक्रिया है, जिसके फलस्वरूप धातु वायुमंडल की वायु और नमी से अभिक्रिया करके अवांछनीय पदार्थों में परिवर्तित हो जाती है। संक्षारण की प्रक्रिया में उपयोगी धातु नमी की उपस्थिति में वायु के ऑक्सीजन द्वारा ऑक्सीकृत होकर ऑक्साइड एवं हाइड्रॉक्साइड के मिश्रण में बदल जाती है। यह प्रक्रिया तब तक जारी रहती है, जब तक कि धातु पूर्णतः समाप्त नहीं हो जाती है।
उदाहरण- (i) लोहे को आर्द्र हवा में छोड़ देने पर कुछ समय के पश्चात् उसकी सतह पर भूरे रंग की परत का बैठ जाना। (ii) ताँबा को बहुत दिनों तक आर्द्र हवा में छोड़ देने पर कुछ समय के पश्चात् उसकी सतह पर हल्के हरे रंग की मलिन परत का बैठ जाना।
नोट: कुछ धातुएँ ऐसी हैं जिनका संक्षारण नहीं के बराबर होता है। इनमें सोना, प्लेटिनम आदि प्रमुख हैं। इसी कारण ये धातुएँ उत्तम कोटि की तथा बहुमूल्य होती हैं।
लोहे में जंग लगना (Rusting of Iron): लोहे में जंग लगना धातु संक्षारण का अच्छा उदाहरण है। वायु और नमी की उपस्थिति में लौह धातु का संक्षारण होता है, इससे लोहे की सतह पर फेरिक ऑक्साइड (Fe2O3) और फेरिक हाइड्रॉक्साइड [Fe(OH)3] की भूरे रंग की ढीली परत बैठ जाती है।
4Fe + 3O2 + 3H2O → Fe2O3 + 2Fe(OH)3
लोहे में जंग लगना एक ऑक्सीकरण अभिक्रिया है।
संक्षारण की शर्ते: धातुओं के संक्षारण के लिए दो शतों का होना आवश्यक है-
(i) ऑक्सीजन या वायु की उपस्थिति तथा
(ii) वायु में नमी की उपस्थिति
गैल्वेनीकरण (Galvanization): लौह धातु पर र्जिक धातु की परत बैठाने की क्रिया को गैल्वेनीकरण कहते हैं। ऐसा लोहा गैल्वेनीकृत लोहा (Galvanized Iron) कहलाता है।
